au sommaire
Comment comprendre le comportement d'un élément chimique lorsque sa demi-vie n'excède pas le millième de seconde ? Grâce à la simulation informatiquesimulation informatique, répond une équipe internationale de chercheurs qui affirme aujourd'hui être en mesure de nous offrir un aperçu de la structure de l'oganesson (Og) -- d'abord baptisé ununoctium --, le plus lourd des éléments connus.
Rappelons que, classiquement, les éléments chimiques sont composés d'un noyau (renfermant lui-même des protons et des neutrons) autour duquel orbitent des électronsélectrons. La mécanique quantique nous apprend plus exactement que ces électrons se concentrent dans certaines régions (de formes et d'énergiesénergies définies) qu'ils remplissent suivant des règles bien précises. Le tout place l'oganesson dans la catégorie des gazgaz nobles, comme le xénonxénon ou le néonnéon.
Mais les choses se compliquent lorsqu'il s'agit d'éléments lourds. En effet, au cœur des atomes superlourds, les électrons les plus éloignés se voient contraints de se déplacer à des vitessesvitesses relativistes pour éviter de tomber sur leur noyau. Mais il semblerait que l'oganesson soit tellement lourd qu'il lui soit impossible de s'organiser comme les autres éléments.
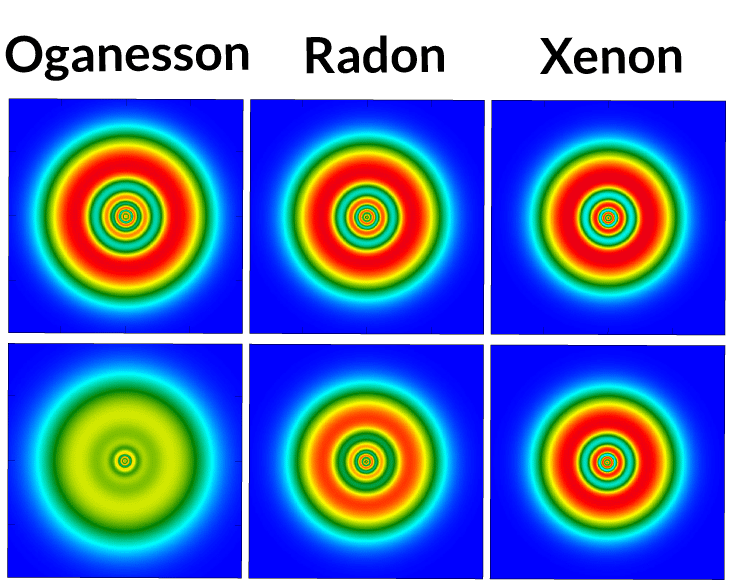
Sur la ligne du haut, la répartition des électrons selon des simulations basées sur la physique classique ; pas de différence marquée entre oganesson, radon et xénon. En revanche, les simulations tenant compte de la relativité donnent, sur la ligne du bas, des résultats bien différents. Pour l’oganesson, la distribution des électrons apparaît plus homogène. © P. Jerabek et al.
Des caractéristiques hors du commun
Première conclusion de l'étude, donc : pas de couches d'électrons bien organisées dans l'oganesson, mais plutôt une sorte de nébuleusenébuleuse. Cette organisation permettrait aux atomesatomes d'oganesson (contrairement à ce qui se passe pour ceux d'autres gaz nobles) :
- d'échanger facilement des électrons avec leur environnement et, ainsi, d'être chimiquement réactifs ;
- de s'agglomérer en un solidesolide à température ambiante.
Le saviez-vous ?
L’oganesson a été baptisé en l’honneur de Iouri Oganessian, directeur du laboratoire russe dans lequel cet élément a été pour la première fois synthétisé au début des années 2000.
Avec ses 118 protons, il est, à ce jour, le plus lourd des éléments du tableau de Mendeleïev.
Les autres conclusions des travaux de l'équipe portent sur le noyau des atomes d'oganesson :
- Le noyau d'oganesson comptant un nombre impressionnant de 118 protons, une bulle de quelques-uns de ceux-ci pourrait se former en son cœur ;
- Les neutrons, quant à eux, semblent ne pas s'organiser en anneaux bien définis.
Pour l'heure, ces résultats, bien qu'importants, restent encore de l'ordre de la prédiction théorique. Une installation destinée à produire des éléments superlourds est en constructionconstruction dans un laboratoire de Doubna (Russie). Elle pourrait bien mettre ces théories à l'épreuve de l'expérience.
Ce qu’il faut
retenir
- L’oganesson est un élément hyperlourd, classé dans la catégorie des gaz nobles.
- À ce jour, seuls quelques atomes d’oganesson ont été produits ; ceux-ci ont été conservés pendant un temps infime tant l’élément est instable.
- Seules les simulations informatiques semblent, pour l’heure, à même d’en dresser un portrait.
- Selon les conclusions d’une étude internationale, la structure même de l’oganesson serait totalement inédite.
























